ESTOS SON PARA TODOS LOS GRUPOS SIN EXCEPCIÓN POR FAVOR SIGANLOS Y ACOMODEN SU PROYECTO DE GRADO A ESTOS ITEMS ESPERAMOS VERLOS EL DÍA MIÉRCOLES Y JUEVES, EN LAS HORAS DE LA MAÑANA SEGUN SEA EL HORARIO ESTABLECIDO LOS DIAS LUNES Y MARTES PORFAVOR REVISEN EL ESTA PAGINA
PARÁMETROS PARA LA PRESENTACIÓN DE PROYECTOS 2010
El proyecto se constituye en un trabajo de investigación final sobre un tema de actualidad que entendido como proyecto debe plantear una propuesta de solución viable, innovadora o recursiva a un problema, situación o necesidad manifiesta dentro de un contexto determinado.
El Colegio Príncipe San Carlos busca que el estudiante se apropie de un tema específico a partir de un interés particular y lo defienda con argumentos propios apoyado en una base conceptual ya establecida que el mismo se encargará de consultar y clasificar.
De acuerdo con el tema, cada grupo contará con la asesoría de un docente quien lo orientará mediante sesiones coordinadas que serán registradas junto con el trabajo y los avances realizados en sus respectivos tiempos.
ENTREGA DEL CD
Fecha Límite: Viernes 8 de Octubre
Presentación: El CD y la caja que lo contiene deben estar etiquetados con el nombre del proyecto y los autores, sobre un fondo alusivo al tema del proyecto.
Contenido: El CD debe contener dos archivos: PROYECTO y PRESENTACIÓN.
PROYECTO: Es un archivo de texto configurado en papel tamaño carta, letra Arial tamaño 12, títulos centrados en mayúsculas y contenidos justificados. Considere las NORMAS ICONTEC para su desarrollo.
PARTES DEL PROYECTO:
PORTADA (Título, Autores, COLEGIO PRÍNCIPE SAN CARLOS, Bucaramanga, 2010).
CONTRAPORTADA (Título, Autores, Proyecto presentado como requisito para optar al Titulo de BACHILLER ACADÉMICO, COLEGIO PRÍNCIPE SAN CARLOS, Bucaramanga, 2010).
AGRADECIMIENTOS (opcional)
INTRODUCCIÓN
CONTENIDO (Tabla de Contenido con paginación)
1. OBJETIVO GENERAL.
2. OBJETIVOS ESPECÍFICOS.
3. JUSTIFICACIÓN. Describe la importancia, la trascendencia, el impacto que tiene el tema a tratar según el contexto en el que se plantea: la comunidad, la ciudad, la región, el país o el mundo.
4. PLANTEAMIENTO DEL PROBLEMA. Debe describir en forma clara el problema, cómo nos afecta o cuál es su incidencia. Se recomienda expresarlo mediante una PREGUNTA PROBLEMA.
5. MARCO TEÓRICO. De acuerdo con el tema se considerará uno o varios de los siguientes aspectos: Marco Histórico, marco conceptual, marco legal, antecedentes.
6. PROPUESTA. La propuesta debe describir cómo los autores sugieren solucionar el problema planteado, o de forma resumida las alternativas de solución.
7. DESARROLLO DE LA PROPUESTA. Describe en forma clara el procedimiento, la metodología las actividades o experimentos realizados y los resultados obtenidos.
8. OBSERVACIONES Y RECOMENDACIONES.
9. CONCLUSIONES.
10. ANEXOS. Cuadros, gráficas, fotografías, o encuestas que sustentan el proyecto o le dan mayor claridad.
11. BIBLIOGRAFÍA Y WEBGRAFÍA.
PRESENTACIÓN: Es un archivo de Power Point, con imágenes, tablas, gráficas o los objetos que considere pertinentes según el tema. Sus contenidos deben ser claros y concretos para evitar la monotonía. El fondo debe permitir la lectura de los contenidos. El número de diapositivas varía entre 15 y 20, con un contenido máximo de 15 líneas por diapositiva.
PARTES DE LA PRESENTACIÓN:
Diapositiva 1: Título del proyecto, autores, Colegio Príncipe San Carlos, 2010.
Diapositiva 2: Introducción.
Diapositiva 3: Objetivo general, Objetivos específicos (IMPORTANTE).
Diapositiva 4: Justificación.
Diapositiva 5: Planteamiento del problema: Pregunta Problema (IMPORTANTE).
Diapositivas (máx. 4): Marco Teórico: De forma muy resumida se presentan los contenidos expuestos en el proyecto.
Diapositiva: Propuesta (IMPORTANTE).
Diapositivas (máx. 4): Desarrollo de la propuesta, metodología, actividades, resultados (IMPORTANTE).
Diapositiva: Conclusiones (IMPORTANTE).
Última Diapositiva: Bibliografía.
Una presentación dinámica es fundamental para la calificación, ese dinamismo depende en gran parte del expositor y del uso que de a sus herramientas, en particular de las diapositivas. Si considera pertinente la presentación de un video, éste no debe exceder una duración de 1 minuto.
OTROS REQUISITOS:
* Publicitar el proyecto con una cartelera o poster desde el día 19 de octubre.
* Diseñar y elaborar 15 plegables para el público asistente con el contenido más relevante del proyecto.
SUSTENTACIÓN DEL PROYECTO: 22 de octubre
* Presentación Personal: Traje Formal (hombres: Traje o pantalón de drill y camisa de manga larga, mujeres: sastre o vestido) no necesariamente de Cocktail.
* Invitados Personales: 2 invitados por estudiante uno de ellos padre o madre (obligatorio).
* Duración de la Exposición: 15 Minutos; 10 minutos para la exposición del ponente y 5 minutos de evaluación y comentarios. Tener en cuenta el manejo del tiempo.
COMITÉ EVALUADOR DE PROYECTOS COLEGIO PRÍNCIPE SAN CARLOS, 2010.
domingo, 10 de octubre de 2010
domingo, 22 de agosto de 2010
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS


11.CARRERA DE LATAS
Materiales
Una tubería de PVC.
Una lata de refresco.
Papel de cocina absorbente.
Fundamento científico
La carga eléctrica es una propiedad que presentan algunas partículas elementales: da lugar a una interacción o fuerza electrostática entre ellas y, por extensión, a muchos fenómenos definidos como eléctricos. La carga aparece en la naturaleza de dos formas diferentes: carga positiva y carga negativa. Entre dos partículas con cargas del mismo signo se establece una fuerza de repulsión; por el contrario, si sus cargas son de distinto signo, la fuerza es de atracción.
Desarrollo
1. Frota un trozo de tubería de PVC con el pañuelo seco durante unos treinta o cuarenta segundos. Inmediatamente adquiere la propiedad de atraer pequeños objetos, como cabellos, confeti y pedacitos de papel.
2. Ahora acércalo a tu lata de refresco.
3. Observa qué sucede y anota a continuación las causas que han provocado lo que has observado
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS

10. CUAL ES EL MAS ACIDO DE EL MERCADO
Materiales
Una bureta
Varios vasos de precipitados de 100 ml
Una pipeta de 10 ml.
Una balanza
Un mortero
Una varilla o un agitador magnético
Una disolución de ácido clorhídrico 0,1 mol/l.
Anaranjado de metilo
Distintos antiácidos del mercado.
Un pHmetro (no es estrictamente necesario)
Procedimiento y explicación
En el mercado farmacéutico existe una amplia variedad de productos para tratar el exceso de acidez de estómago, con acciones diferentes para ejercer su función. Una de ellas es la capacidad neutralizante sobre el ácido clorhídrico estomacal. La experiencia consiste básicamente en la realización de una valoración ácido–base con cada uno de los antiácidos elegidos.
El indicador adecuado es el anaranjado de metilo, ya que su pH de viraje se encuentra entre 3,5 y 4. Sentimos acidez de estomago cuando el pH estomacal es inferior a 1, pero a un pH superior a 4 las enzimas digestivas dejan de funcionar correctamente y se siente la pesadez de estómago. Por ello, el pH de viraje del indicador debe ser alrededor de 4.
Para que una valoración ácido-base sea más precisa es necesario que la reacción de neutralización sea rápida. Esto no se cumple con los antiácidos, algunos de los cuales basan su función precisamente en la lentitud de la reacción. Por esta razón, es importante asegurarse de que la neutralización se ha alcanzado y de que el indicador no cambia nuevamente de color. En este caso es de gran ayuda la utilización del pHmetro y ver la evolución del pH con el paso del tiempo.
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS

9. EXTRACCIÓN DE ADN DEL TEJIDO EPITELIAL.
Material
Sal común (1,5 g).
Bicarbonato de sodio (5 g).
Agua mineral (120 mL).
Lavavajillas (5 mL).
Saliva de la boca (2 mL, aproximadamente).
15 mL de alcohol etílico 96°.
Fundamento científico
La saliva arrastra las células del epitelio que recubre las paredes internas de la boca y que se están desprendiendo constantemente. La sal común (NaCl), con esa concentración, es un medio hipertónico que provoca el estallido de las células y los núcleos, quedando libre las fibras de cromatina. El detergente cumple la misión de formar un complejo con las proteínas histonas y separarlas del ADN.
Desarrollo
1. Cada participante recibe un pequeño frasco de cristal. En él deposita 15 mL de tampón frío que ha pipeteado.
2. A continuación escupe unas siete veces en el interior del frasco, teniendo la precaución de no haber ingerido alimento alguno en los 15 minutos previos.
3. Mueve ligeramente el frasco para que se mezclen bien.
4. Pipetea 15 mL de alcohol de 96° frío y lo deja caer resbalando por las paredes del frasco
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS


9. VELAS AROMATICAS.
Material
Placas eléctricas
Vasos de precipitados
Parafina
Ceras de colores
Moldes de repostería
Mecha de algodón
Aceites esenciales
Procedimiento
Hervir la parafina al baño maría. Colorear con cera de colores y dejar enfriar en el molde donde previamente se ha dejado colocada la mecha. Después, añadir unas gotas de aceites esenciales de lavanda, romero o limón sobre la mezcla.
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS


8. MIS PULMONES
Material
Dos pajitas de refresco
Una botella de plástico con tapón de rosca
Plastilina
Dos gomas elásticas
Un globo verde y otros dos azules
Procedimiento
Corta la botella por la mitad.
Coloca el globo verde cubriendo la base de la botella y sujétalo en posición con una goma elástica.
Haz dos agujeritos en el tapón de la botella. Pasa por ellos las dos pajitas. Sujeta en el extremo inferior de cada pajita un globo azul sujetándolos con una goma. Sella los agujeros del tapón con plastilina.
Enrosca el tapón en la botella, con los dos globos azules dentro de ella.
Tira del globo verde hacia abajo. Esto reduce la presión del aire dentro de la botella. Entonces entra más aire por las pajitas para rellenar este espacio y los globos azules (tus pulmones) se hinchan.
Ahora empuja el globo verde hacia arriba para que el diafragma se contraiga. La presión dentro de la botella aumenta y hace que salga el aire por la pajita. Esto es lo que sucede cuando espiras.
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS


7. CAMARA DE NIEBLA
Material
Un bote de cristal de unos 5 litros
Agua
Una cerilla
Un guante de goma
Procedimiento y explicación
La experiencia permite producir niebla con ayuda de un simple guante. Para ello se cubre el fondo del bote de cristal con agua y se espera unas horas para que parte del agua se evapore. Después se enciende una cerilla y se introduce en el interior del bote, a continuación se coloca el guante y se procede como se indica en la figura. Al subir la mano y cerrar el puño se reduce la presión y baja la temperatura, lo cual provoca la condensación del vapor de agua alrededor de las partículas de humo. Así, aparece una ligera niebla, que al volver la mano a la posición inicial desaparece. El efecto puede repetirse varias veces seguidas.
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS


6. ASI ES MI CORAZON.
Material
Cuatro botellas de plástico con tapón de rosca
Plastilina roja y azul
Dos embudos de plástico
Tubo de plástico de 4 mm de diámetro
Dos pinzas
Colorante alimentario rojo y azul
Cinta adhesiva negra
Procedimiento
Haz un modelo que bombee de verdad para ver cómo funcionan las cuatro cámaras de tu corazón. Imagínate lo fuerte que tiene que ser este músculo para repetir la acción de bombeo, al menos, 60 veces por minuto.
Haz un agujero pequeño en los cuatro tapones. Corta dos trozos cortos de tubo y mete un extremo en cada tapón. Sella los agujeros alrededor del tubo con plastilina roja y azul.
Corta las botellas 1 y 2.
Haz otro agujero más pequeño en el costado de las botellas 3 y 4 (A y B). Introduce un trozo largo de tubo (35 cm aprox. cada uno) por ellos. Sella los agujeros con plastilina.
Enrosca los cuatro tapones en las botellas. Usa cinta adhesiva negra para unir las botellas por parejas.
Llena dos jarras de agua e introduce en una colorante azul y en la otra colorante rojo. El agua roja representa la sangre que contiene oxígeno. El agua azul representa la sangre que vuelve al corazón con poco oxígeno.
Pon las pinzas en los tubos que conectan las botellas. Harán el papel de las válvulas del corazón. Éstas son como puertas que se abren sólo en una dirección.
Utilizando los embudos, echa con cuidado el agua roja en la botella del lado rojo. Luego echa el agua azul en el lado azul. Abre las pinzas para dejar que la "sangre" pase por los tubos, y después ciérralas.
Aprieta las botellas de abajo. Esta acción es semejante al bombeo del corazón. Observa lo rápidamente que sube la sangre por los tubos, lista para circular por todo el cuerpo.
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS

5. ELABORACIÓN DE JABÓN
Materiales
Hidróxido de sodio (sosa cáustica)
Agua
Aceite de girasol o de oliva
Papel secante
Moldes de diferentes formas
Vasos de precipitados
Varilla de vidrio o agitadores magnéticos
Probeta
Balanza
Procedimiento
Se pesan 5 g de hidróxido de sodio y se disuelven en 30 ml de agua. Este proceso físico es exotérmico y por ello se calienta el vaso de precipitados. Se deja enfriar la disolución y sobre ella se añaden 30 ml de aceite. Se agita esta mezcla heterogénea con una varilla de vidrio, siempre en el mismo sentido, y se observa que va espesando al tener lugar una reacción de saponificación. Se deja reposar en un molde sobre papel absorbente para eliminar el exceso de hidróxido de sodio.
El jabón limpia al atraer hacia el centro de la micela a las moléculas apolares (grasas) y la parte exterior de la micela (polar) entra en contacto con el agua. Así se elimina.
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS


4. MIDE TU CAPACIDAD PULMONAR
Materiales
Contenedor de plástico grande
Panel de corcho
Tubo de plástico
Cartulina
Recipiente de plástico de 5 litros (graduado previamente con marcas)
Chinchetas
Procedimiento y explicación
Llenamos el contenedor grande con agua. Introducimos el recipiente de 5 litros "graduado" dentro del agua, asegurándonos de que no quede aire atrapado en su interior. Introducimos un extremo del tubo de plástico dentro del recipiente con marcas, y el otro extremo se utilizará para el soplado desde el exterior. La capacidad respiratoria se medirá en relación con la cantidad de aire acumulado en el interior del recipiente de mediciones después del soplado. Es importante saber que solo se puede soplar una vez. A través del plástico se ve con facilidad el nivel de aire dentro del recipiente; al final de cada día, nuestro gráfico edad/litros de aire espirado mostraba una línea ascendente de capacidad respiratoria hasta los 14 años. A partir de los 14 años la línea era irregular.
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS


3. BREBAJE DE COLORES: REPOLLO ROJO COMO INDICADOR.
Materiales
•Repollo rojo, agua, bicarbonato, limón
•Mechero o cocina portátil y recipiente para cocer
•Bote, colador, embudo y vasos
Procedimiento
Se trata de utilizar la lombarda como un indicador para el reconocimiento de ácidos y bases. Para ello cortamos la lombarda en trozos pequeños, la ponemos en un cazo con agua que la cubra y cocemos. Cuando rompa a hervir se quita, se revuelve y se deja enfriar media hora. Colar el líquido y guardarlo en un bote; este líquido es el indicador. Llenar un vaso con agua, otro con agua de limón, y el tercero con agua de grifo y una cucharadita de bicarbonato. Verter un poco de líquido indicador en cada uno de los vasos ¿Qué pasará en cada uno? ¿Qué ha pasado? ¿Por qué?
DÍA DE LA CIENCIA PRÍNCIPE SAN CARLOS


2. AQUÍ ESTA EL FANTASMA.
Materiales
•Dos vasos de plástico o de cristal
•Ácido clorhídrico
•Amoniaco
•Dos pinceles
•Guantes de goma.
Procedimiento
1.Moja un pincel en ácido clorhídrico (¡no olvides ponerte los guantes!) y pinta un vaso por dentro con cuidado (es un ácido peligroso).
2.Moja otro pincel en amoniaco y pinta otro vaso, también por dentro.
3.Coloca un vaso encima del otro, como en el dibujo.
4.¡Increíble! ¡Aparece un fantasma de humo blanco!
DÍA DE LA CIENCIAS PRÍNCIPE SAN CARLOS


JÓVENES DEL PRÍNCIPE SAN CARLOS. EL PRÓXIMO 27 DE AGOSTO SE LLEVARA A CABO EL DÍA DE LA CIENCIA DENTRO DE NUESTRA INSTITUCIÓN EN ESTA OCASIÓN LA IDEA ES QUE LOS ALUMNOS SE INTEGREN BAJO UNA SOLA EXPRESIÓN Y EN ESTA OPORTUNIDAD SON LAS CIENCIAS LAS QUE TIENEN LA OBLIGACIÓN DE UNIRNOS EN UNA FIESTA. ESTA OPORTUNIDAD ES PARA QUE SE DIVIERTAN Y DIVIERTAN A SUS COMPAÑEROS CON PEQUEÑAS EXPERIENCIAS QUE.
PARA ESTA OCASIÓN LOS ALUMNOS QUE SE HAN INSCRITO VOLUNTARIAMENTE PARA PARTICIPAR SON:
GRUPOS.
ANDRES NARIÑO Y ANDRES GOMEZ.
DAYANNA SANDOVAL Y LUIS MIGUEL SUAREZ.
DAVID LOPEZ Y JUAN CAMILO CUEVAS.
DANIELA DURAN Y DANIELA ARCILA.
STEFANY PULIDO, LAURA SERRANO Y TATIANA CELYS.
MARÍA FERNANDA MEDINA Y CARLOS ROSAS.
JULIO PINTO Y OSKAR SAAVEDRA.
INDIVIDUALES.
DANIELA ZAFRA.
CRISTIAN ANDREI PARRA.
BRAYAN CHAPARRO.
CONDICIONES DE PRESENTACIÓN DE EL TRABAJO.
1. DEBEN REALIZAR DOS VECES LA EXPERIENCIA UNO EN SUS CASA Y OTRO EN EL COLEGIO EL DÍA DE LA MUESTRA DE TRABAJOS ES DECIR EL 27 DE AGOSTO EN LAS HORAS DE LA MAÑANA.
2. DEBEN PRESENTAR UNA CARTELERA TIPO POSTER CON FOTOS, INTRODUCCIÓN FUNDAMENTOS TEÓRICOS, METODOLOGÍA Y RESULTADOS; DEBEN REALIZAR UNA EXPOSICIÓN DE MEMORIA SOBRE LA EXPERIENCIA QUE VAN A REALIZAR.
ESTOS SON LOS EXPERIMENTOS QUE PODEMOS REALIZAR PARA EL DÍA DE LA CIENCIA. PUEDEN ESCOGER UNO O VARIAS EXPERIENCIAS.
1 CROMATOGRAFO DE TINTA.
Los biólogos, médicos y químicos necesitan con frecuencia separar los componentes de una mezcla como paso previo a su identificación.
La cromatografía es una técnica de separación de sustancias que se basa en las diferentes velocidades con que se mueve cada una de ellas a través de un medio poroso arrastradas por un disolvente en movimiento.
Vamos a utilizar esta técnica para separar los pigmentos utilizados en una tinta comercial.
Material necesario
Una tira de papel poroso. Se puede utilizar el papel de filtro de una cafetera o incluso recortar el extremo (sin tinta) de una hoja de periódico.
Rotuladores o bolígrafos de distintos colores.
Un vaso
Un poco de alcohol.
Procedimiento
Recorta una tira del papel poroso que tenga unos 4 cm de ancho y que sea un poco mas larga que la altura del vaso.
Enrolla un extremo en un bolígrafo (puedes ayudarte de cinta adhesiva) de tal manera que el otro extremo llegue al fondo del vaso. (Ver dibujo)
Dibuja una mancha con un rotulador negro en el extremo libre de la tira, a unos 2 cm del borde. Procura que sea intensa y que no ocupe mucho. (Ver dibujo)
Echa en el fondo del vaso alcohol, hasta una altura de 1 cm aproximadamente.
Sitúa la tira dentro del vaso de tal manera que el extremo quede sumergido en el alcohol pero la mancha que has hecho sobre ella quede fuera de él.
Puedes tapar el vaso para evitar que el alcohol se evapore.
Observa lo que ocurre : a medida que el alcohol va ascendiendo a lo largo de la tira, arrastra consigo los diversas pigmentos que contiene la mancha de tinta. Como no todos son arrastrados con la misma velocidad, al cabo de un rato se ven franjas de colores.
Repite la experiencia utilizando diferentes tintas.
domingo, 8 de agosto de 2010
PROYECTOS DE GRADO JORNADA DE LA MAÑANA

JÓVENES DE ONCE CICLOS Y TRADICIONAL, LOS PARÁMETROS PARA LA PRESENTACIÓN DE LA PRIMERA PARTE DE LOS PROYECTOS DE GRADO.
COMENZAMOS LAS ASESORÍAS EL DÍA 15 DE AGOSTO DESDE LAS 8:30 DE LA MAÑANA HASTA LAS 12:00 DEL MEDIO DÍA. LAS VAMOS A TENER DOS VECES AL MES POR LO TANTO LA SIGUIENTE VA A SER EL DÍA 29 DE AGOSTO. EN LA MISMA HORA.
EL DÍA 15 DE AGOSTO TIENEN QUE IR CON LA SIGUIENTE DOCUMENTACIÓN:
NOMBRE DE EL PROYECTO.
UN BOSQUEJO EN BORRADOR PREFERIBLEMENTE A LÁPIZ DE LA IDEA QUE VAN A TRABAJAR, ESTA MÁXIMO DE TRES HOJAS, LOS POSIBLES OBJETIVOS QUE QUIEREN CUMPLIR U UNA IDEA DE LA PROPUESTA QUE VAN A MANEJAR.
MÍNIMO 3 ARTÍCULOS DE REVISTAS O DE LIBROS DONDE SE VEA EL TEMA QUE VAN A TRABAJAR Y DEBEN SER LITERATURA ACTUALIZADA CON UNA ANTIGÜEDAD DE MÍNIMA DE 3 AÑOS.
DEBEN FIRMAR UNA CARTA DE COMPROMETIMIENTO DE QUE ESTUVIERON LE ASESORÍA.
EL DÍA 19 DE AGOSTO DEBEN ENTREGAR EL PRIMER RESUMEN DE TRABAJO MÁXIMO DE DOS HOJAS,LETRA ARIAL No 12; ESPACIO SENCILLO Y JUSTIFICADO, TÍTULOS EN NEGRILLA.
EL RESUMEN DEBE LLEVAR LO SIGUIENTE: TITULO, ESTE DEBE SER CLARO, UN OBJETIVO GENERAL Y MÁXIMO DOS OBJETIVOS ESPECÍFICOS, UN RESUMEN CLARO DE LA METODOLOGÍA Y DE LOS ANTECEDENTES DE DONDE SE VA A APOYAR Y UNA PARTE DE LA POSIBLE PROPUESTA QUE VA A FORMULAR.
EL DÍA SEPTIEMBRE 19 RECOJO UN BORRADOR PRELIMINAR DE EL TRABAJO FINAL ESTE DEBERÁ SER DE UN MÁXIMO DE 10 HOJAS EN LETRA ARIAL 12 A ESPACIO SENCILLO Y JUSTIFICADO, EN DONDE LLEVE LO SIGUIENTE: NO SE REQUIERE PORTADA Y CONTRAPORTADA YA QUE ES UN PRELIMINAR PERO ESTE SERA ENTREGADO A LOS JURADOS PARA QUE EMITAN UN CONCEPTO SOBRE EL TRABAJO.
DEBE LLEVAR LOS OBJETIVOS GENERAL Y ESPECÍFICOS QUE DEBEN SER LOS MISMOS DE EL RESUMEN, UNA INTRODUCCIÓN, UN PLANTEAMIENTO DE EL PROBLEMA, LOS ANTECEDENTES DE SU TRABAJO, ESTO ES UNA RECOPILACIÓN MUY ESPECIFICA DE TODOS LOS TRABAJOS QUE A SU PARECER SON ESENCIALES PARA EL DESARROLLO DE SU TRABAJO;LA METODOLOGÍA QUE USO PARA EL TRABAJO MÁXIMA DE UNA PAGINA Y LOS RESULTADOS QUE YA ESTÉN OBTENIENDO Y UNAS POSIBLES CONCLUSIONES QUE ESTÉN SUSTENTANDO LA PROPUESTA QUE USTED IDEO.
EL DÍA 20 DE OCTUBRE ESTOY RECOGIENDO EL TRABAJO FINAL CON LA PRESENTACIÓN EN PPT. QUE DEBE TENER MÁXIMO 20 DIAPOSITIVAS, EN DONDE USTEDES RESUMAN NOMBRE, OBJETIVOS, INTRODUCCIÓN, JUSTIFICACIÓN,ANTECEDENTES, RESULTADOS, CONCLUSIONES Y PROPUESTA Y AGRADECIMIENTOS.
IMPORTANTE LA PRESENTACIÓN EN PPT NO DEBE TENER MAS DE 10 LINEAS, PREFERIBLEMENTE MANEJEN LOS MAPAS CONCEPTUALES Y REALICEN UNA PRESENTACIÓN ESTUDIADA PREVIAMENTE, LA PRESENTACIÓN ES UN APOYO PERO NO ES UN LIBRO QUE VA A LLEVAR PARA RECITAR, DEBE TENER IMÁGENES Y SER INTERACTIVA
ESTOS ES MI REGLAMENTO: GRUPO QUE FALTE MAS DE DOS VECES A LAS ASESORÍAS PIERDE EL DERECHO A SUSTENTAR SALVO COMPROMISO LABORAL PARA LO CUAL SOLICITARE UNA CONSTANCIA DE TRABAJO DE EL ALUMNO, O EXCUSA MEDICA ELABORADA POR UN MEDICO CON MEMBRETE DE LA EPS.
ALUMNO QUE NO PRESENTE AVANCES MATERIALES EN LAS FECHAS ESTIPULADAS SERA SEGREGADO DE PROCESO DE ASESORÍAS Y PERDERÁ EL DERECHO DE EXPONER EL DÍA DE LA SUSTENTACIÓN. SE HACE VALEDERA LAS EXCUSAS CON LAS CONDICIONES ARRIBA MENCIONADA.
LOS ESTUDIANTES PUEDEN MANDAR UN BORRADOR DE SUS TRABAJOS AL CORREO DE LA PROFESORA CAROLINA O AL MIO cienciascpsc@hotmail.com PARA QUE LO LEAMOS Y VALLAMOS CORRIGIENDO LO QUE VAYAN PRODUCIENDO.
DESPUÉS DE CADA VISITA ASESORA EL ESTUDIANTE FIRMA UNA ASISTENCIA QUE QUEDARA COMO CONSTANCIA DE QUE ASISTIÓ Y CUALES FUERON LAS CORRECCIONES QUE SE HICIERON PARA NO CAER EN REPETICIONES.
CUALQUIER OTRA SUGERENCIA POR FAVOR HÁGANLA SABER Y ESPERO QUE USTEDES RESPONDAN CON LA INQUIETUD DEL QUE ESCUCHA Y ESTA DISPUESTO A APRENDER DE LOS ERRORES PORQUE YO SE QUE COMETERÁN MUCHOS, SU ÉXITO O FRACASO ESTA EN SUS MANOS, NO VEAN ESTA ACTIVIDAD COMO UN REQUISITO PARA GRADUARSE SINO UNA OPORTUNIDAD DE HABLAR DE LO QUE LES INTERESA Y DE DARLA A CONOCER CON LA SENCILLEZ PERO CON LA AUTORIDAD SUFICIENTE PARA DEFENDER SUS IDEAS Y PUNTOS DE VISTA. LOS QUIERO VERLOS DEFENDER SUS TRABAJOS DE GRADO CON MADUREZ Y CON ARGUMENTOS. LOS QUIERO VERSE DIVERTIRSE EN ESA SUSTENTACIÓN Y QUE AL FINAL SE SIENTAN ORGULLOSOS DE LO QUE HICIERON Y QUE NADIE LES VA A QUITAR ESO.
MUCHAS GANAS Y RESPONSABILIDAD QUIERO ESO PARA ESTE GRUPO.
QUE TENGAN BUEN VIENTO Y BUEN REMAR......
domingo, 13 de junio de 2010
CUESTIONARIO DE REPASO PARA LOS NIÑOS DE SEXTO

Este cuestionario les va a ayudar a ubicarse mejor en el previo acumulativo resuelvanlo a mano en hojas tipo examen, yo lo recojo el dia de el previo acumulativo y lo voy a valer como taller, de acá van a salir las preguntar de el previo así que estúdienlo muy bien háganlo completo y a conciencia para que puedan responder con propiedad el previo.nos vemos el día de el previo cuídense !!!!!
1.Describe el concepto del átomo según Demócrito
2. Cuáles son las ideas básicas de la teoría de Dalton
3. Mencione los postulados de Dalton que son incorrectos
4. Escribe dos características principales del átomo de Rutherford
5. Escribe las similitudes y diferencias que hay entre el modelo atómico de Rutherford y Bohr
6. Escribe el concepto de átomo
7. Escribe el nombre de las tres partículas fundamentales del átomo e indique la masa y carga asociada con cada una de ellas
8. ¿Cuáles son las partículas fundamentales que constituyen el núcleo del átomo?
9. ¿Cuáles son las partículas fundamentales que contribuyen a que el átomo sea neutro
10. Escribe la posición en que se encuentran las tres partículas fundamentales en el átomo
11. Define el número atómico (Z)
12. Define el número másico (A)
13. Escribe la ecuación matemática de A (número másico) y despeja el número de
neutrones (n0)
14. ¿Cómo se llaman los átomos del mismo elemento, pero con diferente número
másico?
15. Escribe las semejanzas y diferencias que existen entre los isótopos de un mismo
elemento
16. ¿Cuál es el número másico de un átomo de hierro (Fe) que tiene 28 neutrones?
CHICOS DE DÉCIMO CICLOS JORNADA DE LA TARDE


DESARROLLEN LOS SIGUIENTES EJERCICIOS, JÓVENES TRATEN DE REALIZAR TODOS LOS EJERCICIOS Y Y ENTREGARLOS EL DÍA DEL EL EXAMEN ACUMULATIVO EN HOJAS TIPO EXAMEN A MANO.
A ) Nombre los siguientes compuestos:
1 ) K 2 O
2 ) Cu O
3 ) Fe 2 O 3
4 ) C O
5 ) C O 2
6 ) N O
7 ) N O 2
8 ) N a H
9 ) Ca H 2
10 ) H I
11 ) H F
12 ) H 2 S
13 ) K O H
14 ) Al ( O H ) 3
15 ) H I O
16 ) H Cl O 2
17 ) H 3 P O 3
18 ) H N O 3
19 ) H 2 S O 3
20 ) H 3 P O 4
21 ) K I
22 ) Na Cl O
23 ) Ca ( I O 3 ) 2
24 ) Mg Br 2
25 ) Ba S O 4
26 ) Cu S O 3
27 ) Fe S
28 ) Ag N O 3
29 ) Na H C O 3
30 ) K Mn O 4
2. Completa con formulas y nombres las siguientes reacciones de formación de sales:
a) Hidroxido de sodio + acido bromhidrico ______________________________________________
b) Hidroxido de potasio + acido clorhidrico ____________________________________________
c) Hidroxido de litio + acido carbonico _________________________________________________
d) Hidroxido de magnesio + acido fluorhidrico__________________________________________
e) Hidroxido de calcio + acido sulfihidrico _____________________________________________
f) Hidroxido cromoso + acido nitrico___________________________________________________
g) Hidroxido cromico + acido fosforoso _______________________________________________
h) Hidroxido ferroso + acido sulfurico ________________________________________________
i) Hidroxido cuprico + acido hiperclorico______________________________________________
j) Hidroxido aurico + acido bromoso___________________________________________________
k) Hidroxido ferrico + acido yodico ____________________________________________________
l) Hidroxido auroso + acido fosforico _________________________________________________
3. Que semejanzas o relación encuentran entre.
A. el numero de oxidacion mas comun de un atomo y su numero de electrones de valencia.
B. La tendencia de una atomo a formar un enlace ionico y su energia de ionizacion.
C. La electronegatividad de dos atomos y la tendencia a adquirir o ceder electrones de este.
D. El numero de oxidacion y el caracter metallico.
Defina que el un enlace polar.
Que es un enlace apolar
Que es un enlace dipolo-dipolo
4. Realiza el punto que aparece en la figura arrina. Que tiene que ver con estructura de lewis y formación de enlaces.
5.Escrban los números de oxidación de las siguientes reacciones.
A. N2 + H2 → NH2.
B. MnO2 + 2HCl → MnCl2 + Cl2 + H2O
C. H2SO4 (ac) + NaOH(ac) → Na2SO4(ac) + H2O
D. CuSO4 + Fe → FeSO4 + Cu
7. Estudie toda la teoría que hemos tratado en clase, incluso la teoría de los talleres, tengan claro como se maneja la tabla periódica, sepan distinguir que son metales, que no son metales, por favor lean bien lo que se les pregunta, no respondan ala loca, sean cautos en ese sentido, hagan el taller a conciencia, lo que no entiendan vamos a resolverlo el martes. No resuelvo dudas que ya hemos tratado en la clase de le sábado. cuídense y háganme caso...aunque sea una vez!!!!!
domingo, 9 de mayo de 2010
CHICOS DE DÉCIMO CICLOS

ESTOS EJERCICIOS QUEDAN PROPUESTOS PARA QUE LOS TRAIGAN EN FORMA DE TAREA EL DÍA JUEVES 13 DE MAYO EN LA HORA DE QUÍMICA.
EJERCICIOS DE FORMULACIÓN Y NOMENCLATURA
1. Determina el número de oxidación del manganeso en los compuestos:
a. MnO2 b. Mn2O3
2. Determina el número de oxidación del Cl en los compuestos:
a. Cl2O7 b Cl2O c. Cl2O5
3. Determina el número de oxidación del Ni en los compuestos:
a. Ni2O3 b. NiO
4. Formula los siguientes óxidos:
Óxido de titanio (IV): _____________
Óxido de cobre (II): _____________
Óxido de calcio: _____________
Óxido de sodio: _____________
Óxido férrico: _____________
Óxido auroso: _____________
Óxido de fósforo (III): _____________
Óxido de boro: _____________
Óxido de selenio (VI): _____________
Óxido de arsénico (III): _____________
Óxido de yodo (V): _____________
5. ESCRIBA EL NOMBRE DE LOS SIGUIENTES OXIDOS Y ACIDOS EN NOMECLATURA STOCK Y TRADICIONAL.
MgO
PbO2
Hg2O
PbO
HgO
CrO
CuO
Cu2O
PtO
PtO2
Ni2O3
NiO
SnO
SnO2
HNO3
HClO
H2SO4
H3PO4
H2Cr2O7
HClO2
H2CO3
HIO4
HMnO4
H2SeO3
H2SO3
H4SiO4
H2CrO4
HNO2
HBrO3
H2TeO3
H3AsO3
H2MnO4
HBrO2
sábado, 1 de mayo de 2010
TALLER DE CHICOS DE ONCE Y DÉCIMO TRADICIONAL DE ÉTICA....

COMENZAMOS EL DÍA LUNES MUCHO OJO TODOS CON EL CUESTIONARIO COMPLETO, PARA DESARROLLARLO EN CLASE.
QUIEN SOY YO.
1. DIBUJARME QUE ES LO QUE MAS ME GUSTA DE MI Y LO QUE MENOS ME GUSTA.
2. A QUE LE TENGO MIEDO.
3. QUE COSAS HAGO MAL.
4. QUE COSAS HAGO BIEN.
5. QUE NECESITO APRENDE.
6. QUE ME INTERESA.
7.CUALES SON MIS GUSTOS.
8 ESCRIBO MI AUTOBI0GRAFIA.
9. ELIJO 5 ASPECTOS DE MI PERSONALIDAD QUE NO SON FÍSICOS.
10. ESCRIBO TODO AL RESPECTO DE MI VIDA ESPIRITUAL.
11. ESCRIBO 5 ASPECTOS CON RESPECTO A MI ASPECTO EMOCIONAL.
12. QUIEN QUIERO SER?
13. QUE QUIERO CAMBIAR.
14. QUE QUIERO CAMBIAR.
15. QUE TE GUSTARÍA QUE TE PASARA EN LOS ASPECTOS SOCIAL, FÍSICO, EMOCIONAL Y ESPIRITUAL.
TRAIGAN ESTE CUESTIONARIO IMPRESO SOLO EL CUESTIONARIO ACUÉRDESE QUE LO VAMOS A REALIZAR EN CLASE. EL DÍA LUNES 3 DE MAYO. CUIDESEN, NOS VEMOS Y FELIZ FIN DE SEMANA
CHICOS DE ONCE CICLOS



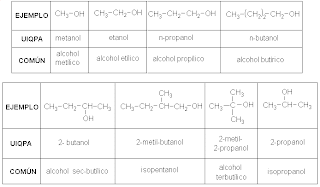

ESTA ES LA TEORÍA QUE VAMOS A TRABAJAR.GUARDENLA EN SUS CUADERNOS O CARPETAS DE APUNTES.
SOBRE LOS ALCOHOLES.
ALCOHOLES
Los alcoholes son los derivados hidroxilados de los hidrocarburos, al sustituirse en estos los {átomos de hidrogeno por grupos OH. según el número de grupos OH en la molécula, unido cada uno a ellos a distinto átomo de carbono, se tienen alcoholes mono, di, tri y polivalentes. los alcoholes alifáticos monovalentes son los más importantes y se llaman primarios, secundarios y terciarios, según el grupo OH se encuentre en un carbono primario, secundario o terciario:
Según la naturaleza del C al cual está ligado el OH, se pueden clasificar en primarios, secundarios o terciarios
Los alcoholes se designan siguiendo las reglas de la UIQPA. Se consideran como derivados de los alcanos en los cuales se sustituye o por ol o se les designa con le nombre común, anteponiendo al nombre del grupo alquílico la palabra alcohol.
CHICOS DE NOVENO...TALLER!!!!!

PARA RESPONDER EN EL CUADERNO Y PRESENTAR EN FORMA DE TAREA.
1. HALLAR LOS PESOS MOLECULARES DE LOS SIGUIENTES COMPUESTOS.
A.CaCO3
B.HNO3
C.H2SO4
D.H3PO4
E.H2O.
F.SO2
G.Fe(OH)3
H. HClO
I. Fe(NO3)2
J. Al(ClO3)3
2.El número de gramos que hay en dos moles de aspirina cuya fórmula es C9H8O4.
3. Si tuviera 2,8 gramos de oro, ¿cuántos MOLES de oro tendría?
4. Calcular la masa de 1,5 moles de cloruro de calcio CaCl2
5.Cuantos moles de NaCl existen
CHICOS DE OCTAVO. LEAN MUY BIEN PARA QUE NO SE EQUIVOQUEN POR FAVOR.



PARA LA PRÓXIMA CLASE DE QUÍMICA DEBEN TRAER LOS SIGUIENTES EJERCICIOS COPIADOS EN EL CUADERNO DE APUNTES....OJO SOLO ESTA TAREA NO REALICEN EL TRABAJO DE TABLA PERIÓDICA AUN....
1. QUE EL NUMERO ATÓMICO.
2. QUE SON LOS NÚMEROS CUÁNTICOS, CUANTOS NÚMEROS CUÁNTICOS EXISTEN, CUALES SON SUS CARACTERÍSTICAS.
3. REALIZAR LA CONFIGURACIÓN ELECTRÓNICA DE LOS SIGUIENTES ELEMENTOS.
Z = 66; 9; 13; 52; 36; 45; 16.
LA TABLA PERIÓDICA
Breve historia del Sistema Periódico
En 1817, Dobereiner elaboró un documento que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades. Destaca la existencia de similitudes entre elementos agrupados en tríos que él denomina “tríadas”. La tríada del cloro, del bromo y del yodo es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos. En 1850 se contaba con unas 20 tríadas para llegar a una primera clasificación coherente.
En 1862 el francés Chancourtois pone en evidencia una cierta periodicidad entre los elementos de la tabla. En 1864 Chancourtois y el inglés Newlands anuncian la Ley de las octavas: las propiedades se repiten cada ocho elementos. Pero esta ley no puede aplicarse a los elementos más allá del Calcio. Aunque esta clasificación resulta insuficiente la tabla periódica comienza a ser diseñada.
En 1869, el alemán Meyer pone en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante. Simultáneamente con el ruso Mendeleïev, presentan una primera versión de la tabla periódica en 1869. Esta tabla fue la primera presentación coherente de las semejanzas de los elementos. Los elementos se clasificaban según sus masas atómicas, viéndose aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos. Esta tabla fue diseñada de manera que hiciera aparecer la periodicidad de los elementos. De esta manera los elementos son clasificados verticalmente. Las agrupaciones horizontales se suceden representando los elementos de la misma “familia".
Para poder aplicar la ley que Mendeleïev creía cierta, tuvo que dejar ciertos huecos vacíos. Él estaba convencido de que un día esos lugares vacíos no lo estarían más, y los descubrimientos futuros confirmaron esta convicción. Consiguió además prever las propiedades químicas de tres de los elementos que faltaban a partir de las propiedades de los cuatro elementos vecinos. Cuando los elementos fueron descubiertos, ellos poseían las propiedades predichas.
Sin embargo aunque la la clasificación de Mendeleïev marca un claro progreso, contiene ciertas anomalías debidas a errores de determinación de masa atómica de la época como la del Te y la del I, y la de algún otro par de elementos.
Los gases nobles se incorporaron más adelante, cuando fueron descubiertos, como una columna más.
Fue a principios del siglo XX cuando Henry Moseley cuando se propuso la ordenación por número atómico y cuando se supo en realidad cuántos huecos había en la tabla periódico (elementos no identificados hasta el momentO)
Grupos y períodos
El sistema periódico consta de filas (líneas horizontales) llamadas períodos y de columnas (líneas verticales) llamadas grupos.
Los elementos conocidos hasta el momento se organizan en siete períodos y dieciocho grupos. Tenemos ocho grupos largos y diez cortos. También nos encontramos con dos filas que habitualmente se colocan fuera de la tabla periódica, las denominadas 'Tierras Raras' o 'Metales de transición externa', por propiedades esos elementos deberían estar en el La y en el Ac, cada una de las filas en uno de ellos; por dicho motivo, los elementos que tienen propiedades similares al lantano se denominan lantánidos (primera de las dos filas) y los otros (segunda fila de las dos) con propiedades parecidas al Actinio, actínidos.
Metales, no metales, gases nobles
Una primera clasificación de la tabla es entre Metales, No Metales y Gases Nobles. La mayor parte de los elementos de la tabla periódica son metales.
Observa que puedes seguir una pauta muy sencilla para estudiar los no metales.
Los no metales comienzan en el grupo de los térreos con el primero (B).
La siguiente columna (grupo de los carbonoideos) son dos (C y Si).
La siguiente columna (grupo nitrogenoideos) son tres (N, P y As).
La siguiente columna (anfígenos) son cuatro (O, S, Se y Te).
La siguiente columna (halógenos) son cinco (F, Cl, Br, I y At).
Sólo queda el hidrógeno (H) que suele considerarse no metal.
Aprendiendo los no metales y la columna de los gases nobles, podrás saber si un elemento determinado es metal, no metal o gas noble: no metal o gas noble por haberlo estudiado, metal por exclusión. Este conocimiento resulta de importancia en la predicción del tipo de enlace entre átomos.
Tipos de elementos
Los metales los solemos clasificar de la siguiente forma:
Metales reactivos. Se denomina así a los elementos de las dos primeras columnas (alcalinos y alcalinotérreos) al ser los metales más reactivos por regla general.
Metales de transición. Son los elementos que se encuentran entre las columnas largas, tenemos los de transición interna (grupos cortos) y transición externa o tierras raras (lantánidos y actínidos).
Otros metales. Son los que se encuentran en el resto de grupos largos. Algunos de ellos tienen propiedades de no metal en determinadas circunstancias (semimetales o metaloides).
Los no metales, algunos de los cuales, los que se encuentran cerca de la línea de separación metal / no metal, tienen un comportamiento metálico en determinadas circunstancias (semimetales o metaloides).
Gases Nobles o gases inertes.
Propiedades de los elementos según su tipo
Propiedades de los metales.
Por regla general los metales tienen las siguientes propiedades:
Son buenos conductores de la electricidad.
Son buenos conductores del calor.
Son resistentes y duros.
Son brillantes cuando se frotan o al corte.
Son maleables, se convierten con facilidad en láminas muy finas.
Son dúctiles, se transforman con facilidad en hilos finos.
Se producen sonidos característicos (sonido metálico) cuando son golpeados.
Tienen altos puntos de fusión y de ebullición.
Poseen elevadas densidades; es decir, tienen mucha masa para su tamaño: tienen muchos átomos juntos en un pequeño volumen.
Algunos metales tienen propiedades magnéticas: son atraídos por los imanes.
Pueden formar aleaciones cuando se mezclan diferentes metales. Las aleaciones suman las propiedades de los metales que se combinan. Así, si un metal es ligero y frágil, mientras que el otro es pesado y resistente, la combinación de ambos podrías darnos una aleación ligera y resistente.
Tienen tendencia a formar iones positivos.
Hay algunas excepciones a las propiedades generales enunciadas anteriormente:
El mercurio es un metal pero es líquido a temperatura ambiente.
El sodio es metal pero es blando (se raya con facilidad) y flota (baja densidad)
Propiedades de los no metales:
Son malos conductores de la electricidad.
Son malos conductores del calor.
Son poco resistentes y se desgastan con facilidad.
No reflejan la luz como los metales, no tienen el denominado brillo metálico. Su superficie no es tan lisa como en los metales.
Son frágiles, se rompen con facilidad.
Tienen baja densidad.
No son atraídos por los imanes.
Tienen tendencia a formar iones negativos.
Hay algunas excepciones a las propiedades generales enunciadas anteriormente:
El diamante es un no metal pero presenta una gran dureza.
El grafito es un no metal pero conduce la electricidad.
Semimetales o metaloides.
Se encuentran entre lo metales y los no metales (B, Si, Ge, As, Sb, Te, Po). Son sólidos a temperatura ambiente y forman iones positivos con dificultad. Según las circunstancias tienen uno u otro comportamiento.
Hidrógeno.
Aunque lo consideremos un no metal, no tiene las características propias de ningún grupo, ni se le puede asignar una posición en el sistema periódico: puede formar iones positivos o iones negativos.
Gases Nobles o Gases Inertes.
La característica fundamental es que en condiciones normales son inertes, no reaccionan con ningún elemento ni forman iones.
CUESTIONARIO. DEBEN ENTREGARLO EN HOJAS TIPO EXAMEN Y ANEXADO A LA CARPETA DE QUÍMICA PARA LA REVISIÓN.
Para poder responder a estas cuestiones debes observar una tabla periódica:
1.- ¿Qué es un grupo?
2.- ¿Cuántos grupos hay?
3.- ¿Qué es un periodo?
4.- ¿Cuántos periodos hay?
5.- ¿Qué tienen en común los elementos de la tabla periódica que están colocados en la misma columna? ¿Y los que están colocados en la misma fila?
6.- ¿Qué criterio es el utilizado para ordenar los elementos en la tabla periódica? ¿Siempre ha sido así?
7.- Observa la estructura electrónica de algunos elementos y su posición en la tabla periódica, ¿hay alguna relación?
8.- La ordenación que hicieron Mendeleiev y Meyer se basó en la masa atómica (de izquierda a derecha y de arriba abajo iba aumentando la masa atómica); la actual debida a Moseley, se basa en el número atómico. Esta ordenación casi coincide con la de la masa; ¿qué elementos no siguen la ordenación creciente de masas atómicas?
9.- En la tabla existen elementos metálicos, no metálicos, sólidos, líquidos, gases, etc. Observa detalladamente la tabla periódica y entre los primeros 103 elementos escribe el nombre de aquellos que son: sólidos; líquidos; gases; preparados artificialmente; metales; no metales; semimetales; gases nobles; alcalinos; halógenos; lantánidos. Completa esta hoja.
10.- Los nombres de los elementos tienen diversos orígenes; algunos se han formado a partir de algún lugar geográfico o científico famoso. Localiza en la tabla los elementos que representan los siguientes símbolos y averigua cuáles tienen relación con el nombre de algún científico y cuáles con el de algún lugar: Es, Md, Rf, Ga, Po, Ge, Mg, Eu, Fm.
11.- Hay otros elementos cuyo símbolo no procede de su nombre castellanizado, como por ejemplo Na (sodio), K (potasio), Hg (mercurio), etc. Investiga de dónde procede el símbolo de los siguientes elementos: sodio, potasio, hierro, cobre, plata, oro, mercurio, estaño, plomo, fósforo, antimonio, azufre.
12.- Busca en las tablas que te propongo los puntos de fusión y ebullición de los veinte primeros elementos:
a) Dibuja en Openoffice Calc la gráfica de los valores de los puntos de fusión en relación con el número atómico.
b) Dibuja la gráfica similar con los puntos de ebullición.
c) ¿Observas alguna periodicidad en los valores de los puntos de fusión y de ebullición?
13.- ¿Qué son los biolementos?
14.- Existen seis elementos que constituyen, prácticamente, el 99% de toda la materia viva, ¿cuáles son? Cita algunas propiedades de ellos.
15.- El sodio, potasio, cinc, yodo, magnesio, fósforo, hierro y calcio, entre otros, son denominados elementos minerales y desempeñan funciones importantes en nuestro organismo
CHICOS DE SEXTO Y SÉPTIMO.



ESTE ES EL PRÓXIMO TEMA DE QUÍMICA, A CONTINUACIÓN SE PUBLICARAN VARIOS VARIOS LABORATORIOS CASEROS QUE EXPLICAN LOS FENÓMENOS QUE VEREMOS EN CLASE CON UN Y QUE LES AYUDARAN A ENTENDER MUCHO MAS EL TEMA. ES NECESARIO QUE SIGAN LOS MISMOS PASOS QUE YA HEMOS TRABAJADO, DEBEN TOMAR LAS FOTOS ENVIÁRMELAS A cienciascpsc@hotmail.com Y LUEGO REALIZAR EL INFORME ESCRITO COMO YO LES DI LOS PASOS EN CLASE, RESPONDER EL CUESTIONARIO QUE VIENE CON LA EXPERIENCIA DE LABORATORIO Y ANEXARLA A LA CARPETA DE GUÍAS DE TRABAJO EN CLASE. ESTE TRABAJO DEBEN PRESENTARLO EL DÍA 11 DE MAYO Y LAS FOTOS A MAS TARDAR EL DÍA 9 DE MAYO.
VELOCIDAD DE LAS REACCIONES QUÍMICAS.
Velocidad de las reacciones químicas y concentración
La rapidez con la que se produce una transformación química es un aspecto muy importante. Tanto desde el punto de vista del conocimiento del proceso como de su utilidad industrial, interesa conocer la velocidad de la reacción y los factores que pueden modificarla.
Se define la velocidad de una reacción química como la cantidad de sustancia formada (si tomamos como referencia un producto) o transformada (si tomamos como referencia un reactivo) por unidad de tiempo.
La velocidad de reacción no es constante. Al principio, cuando la concentración de reactivos es mayor, también es mayor la probabilidad de que se den choques entre las moléculas de reactivo, y la velocidad es mayor. a medida que la reacción avanza, al ir disminuyendo la concentración de los reactivos, disminuye la probabilidad de choques y con ella la velocidad de la reacción.La medida de la velocidad de reacción implica la medida de la concentración de uno de los reactivos o productos a lo largo del tiempo, esto es, para medir la velocidad de una reacción necesitamos medir, bien la cantidad de reactivo que desaparece por unidad de tiempo, bien la cantidad de producto que aparece por unidad de tiempo.La velocidad de reacción se mide en unidades de concentración/tiempo, esto es, en moles/s.
El aumento de la concentración de los reactivos hace más probable el choque entre dos moléculas de los reactivos, con lo que aumenta la probabilidad de que entre estos reactivos se de la reacción. En el caso de reacciones en estado gaseoso la concentración de los reactivos se logra aumentando la presión, con lo que disminuye el volumen.
Si la reacción se lleva a cabo en disolución lo que se hace es variar la relación entre el soluto y el disolvente.
En la simulación que tienes a la derecha puedes variar la concentración de una o de ambas especies reaccionantes y observar cómo influye este hecho en la velocidad de la reacción química.
¿De qué depende que una reacción sea rápida o lenta? ¿Cómo se puede modificar la velocidad de una reacción? Una reacción química se produce mediante colisiones eficaces entre las partículas de los reactivos, por tanto, es fácil deducir que aquellas situaciones o factores que aumenten el número de estas colisiones implicarán una mayor velocidad de reacción. Veamos algunos de estos factores.
Temperatura
Al aumentar la temperatura, también lo hace la velocidad a la que se mueven las partículas y, por tanto, aumentará el número de colisiones y la violencia de estas. El resultado es una mayor velocidad en la reacción. Se dice, de manera aproximada, que por cada 10 °C de aumento en la temperatura, la velocidad se duplica.
Esto explica por qué para evitar la putrefacción de los alimentos los metemos en la nevera o en el congelador. Por el contrario, si queremos cocinarlos, los introducimos en el horno o en una cazuela puesta al fuego.
CUESTIONARIO. CONSIGNAR EN EL CUADERNO DE APUNTES DE QUÍMICA
1. BUSQUEN EN EL DICCIONARIO LAS SIGUIENTES PALABRAS.
TRANSFORMACIONES; CONCENTRACIÓN; TEMPERATURA; DISOLUCIÓN; REACTIVO QUÍMICO; COMPUESTO QUÍMICO. PUTREFACCIÓN; SOLVENTE.
2. CUALES SON LOS FACTORES SON LOS QUE INFLUYEN EN LA VELOCIDAD DE UNA REACCIÓN.
3. QUE SON LOS MOLES Y CUAL ES LA IMPORTANCIA DE ELLOS EN LA VELOCIDAD DE LAS REACCIONES.
CUESTIONARIO DEL EXPERIMENTO.
1. REALICEN LA EXPERIENCIA PRIMERO LLENANDO DOS VASOS CON 50 MILILITROS Y LUEGO REALICEN LA EXPERIENCIA CON 100 MILILITROS DE AGUA, MIDAN EL TIEMPO DE LA REACCIÓN CON UN CRONOMETRO EN CADA UNO DE LAS EXPERIENCIAS. LUEGO EXPLIQUE SI LA VELOCIDAD DE LA REACCIÓN SE VE AFECTADA POR EL CAMBIO DE VOLUMEN. ARGUMENTE RAZONABLEMENTE SU RESPUESTA.
2.QUE SUCEDE CUANDO SE LE AGREGA A LOS VASOS TANTO EL FRIÓ COMO EL CALIENTE MEDIA COPA DE ACEITE Y VUELVE Y SE LE AGREGA LA PASTILLA EFERVESCENTE, VUELVAN Y MIDAN EL TIEMPO Y EXPLIQUE SI CON SUSTANCIA QUE NO SE MEZCLAN EL TIEMPO SE VE AFECTADO.
3. SATUREN LA SOLUCIÓN DE AGUA FRIÓ Y DE AGUA CALIENTE CON SAL Y AGREGUEN NUEVAMENTE OTRA PASTILLA EFERVESCENTE Y MIDAN EN TIEMPO Y EXPLIQUEN SI LA REACCIÓN SE VE AFECTADA CUANDO SE DA EN COMPUESTOS SATURADO.
NOTA:
EL LABORATORIO DEBE SER PRESENTADO A MANO EN HOJAS TIPO EXAMEN EL DÍA 11 DE MAYO. ESTE ES EL LINK DE LA EXPERIENCIA DE LABORATORIO PARA QUE LA PUEDAN REALIZAR.
http://www.youtube.com/watch?v=MuoEvR_BbAY
martes, 27 de abril de 2010
TODOS LOS ALUMNOS QUE VEN RELIGIÓN EN TRADICIONAL
chicos de DÉCIMO CICLOS

ESTA ES LA TEORIA QUE VAMOS A MANEJAR EN LAS SIGUIENTES CLASES TRATEN DE TOMAR LOS APUNTES O TENERLAS EN SUS CARPETAS PORQUE SON LOS FUNDAMENTOS TEÓRICOS, ESTUDIEN....
NOMENCLATURA QUÍMICA
INTRODUCCIÓN
La QUIMICA tiene como objeto de estudio la MATERIA, su composición atómica, estructura molecular, y las transformaciones que le pueden ocurrir. Entendemos por MATERIA a toda aquellas SUSTANCIAS que existen en la naturaleza y que tienen masa, encontrándose regularmente en forma de MEZCLAS, pero que sus componentes se pueden separar.
SUSTANCIA es la materia en estado de pureza, formada de un conjunto de moléculas iguales aglutinadas por fuerzas intermoleculares.
Estas sustancias deben identificarse mediante nombres específicos. Este NOMBRE debe llevar inherente la mayor información posible sobre la sustancia referida. Ya sea de acuerdo a su composición molecular, sus propiedades físicas o a la familia a que pertenece, estableciéndose así una SISTEMATIZACION de todas ellas que facilite su NOMENCLATURA.
En esta unidad nos referiremos únicamente a las sustancias clasificadas como inorgánicas, excluyendo a las orgánicas, por su extenso contenido de estudio, que requeriría todo un curso aparte. (Materia de Química III)
Objetivo del tema.
Que el alumno sea capaz de identificar y nombrar a la sustancia con su nombre químico, predecir y escribir su fórmula utilizando la simbología y nomenclatura recomendada; determinar la reacción de formación y balancearla por el método de prueba y error.
PREDICCIÓN DE FÓRMULAS QUÍMICAS
Para escribir la fórmula química de una sustancia inorgánica, se debe saber que se forma por medio de enlaces químicos de tipo iónico, es decir se unen partículas iónicas positivas (llamadas cationes) con partículas iónicas negativas (llamadas aniones), por atracciones electrostáticas.
Los cationes son los átomos que por su baja electronegatividad pierden electrones de la última capa de su configuración electrónica y los aniones son los que por su alta electronegatividad ganan electrones en el intento del enlace químico, para lograr cada uno tener ocho electrones en su última capa como lo tienen los gases inertes.
La FORMULA QUIMICA y el nombre se la sustancia se escriben aplicando las reglas establecidas por la UNION INTERNACIONAL DE QUIMICA PURA Y APLICADA (siglas en inglés I.U.P.A.C.).
Ejemplo 1.- Si se une el catión Ca +2 y el anión Cl -1 se obtiene la molécula CaCl2 ; el (+2) y el (-1) son las cargas eléctricas llamadas números de oxidación de cada átomo.
Ejemplo 2.- Si se une el catión Al+3 y el anión Cl -1 ¿que fórmula de la molécula se obtiene?.
SUSTANCIAS SIMPLES Y COMPUESTAS
Dentro de la gran diversidad de sustancias existentes en la naturaleza y que son estables en condiciones ambientales, se puede distinguir dos grupos: SUSTANCIAS SIMPLES o ELEMENTALES y SUSTANCIAS COMPUESTAS.
Una SUSTANCIA es SIMPLE cuando no puede ser descompuesta en otra más sencilla por ningún método físico o químico reconocido como de uso común. Las sustancias simples son llamadas también ELEMENTOS y se representan mediante SIMBOLOS donde siempre la primera letra del nombre es escrita en mayúscula pudiendo estar acompañada de una segunda letra en minúscula. Ejemplos: Cu (cobre), Al (aluminio), Na (sodio), K (Potasio), Ca (Calcio), Pb (Plomo), P (Fósforo), C (Carbono), Au (Oro), He (Helio) .
Son también sustancias simples las que están conformadas con Moléculas sencillas, o sea aquellas que están formadas por un átomo o por la asociación de átomos de un sólo tipo.
O2 (molécula de Oxígeno), O3 (molécula de Ozono), Cl2 (molécula de Cloro), H2 (molécula Hidrógeno),
Las SUSTANCIAS COMPUESTAS pueden descomponerse en sustancias simples y se representan mediante FORMULAS las cuales están conformadas por cantidades y símbolos de los átomos que forman al compuesto, de suerte tal, que la fórmula nos brinde información tanto cualitativa como cuantitativa sobre la composición de la sustancia:
H2O (Agua ): 2 átomos de sodio y un átomo de oxígeno
NH3 (Amoníaco): 1 átomo de nitrógeno y tres átomos de hidrógeno
Otros ejemplos: Na2O (óxido de Sodio), CaS (Sulfuro de Calcio), CO (Monóxido de Carbono), KBr (Bromuro de Potasio).
FAMILIAS DE SUSTANCIAS QUIMICAS
Si bien hemos visto que las sustancias se clasifican en simples y compuestas según contengan moléculas simples o compuestas. Estas clasificaciones nos sirven de gran ayuda en la escritura de las fórmulas, pero es poca la información que nos brindan sobre las propiedades tanto físicas como químicas de la sustancia, es por ello que resulta indispensable otra clasificación que los agrupe de acuerdo a sus propiedades químicas comunes; para tal efecto surgen las siguientes funciones químicas y grupos funcionales.
OXIDOS
Son compuestos binarios formados por la combinación del oxígeno con otro elemento, si el elemento es un METAL se le conoce como OXIDO METALICO o también como OXIDO BASICO. En el caso de que fuera un NO METAL se le denomina OXIDO NO METALICO u OXIDO ACIDO, y en ocasiones a algunos se les puede denominar ANHIDRIDOS.
ACIDOS
Son compuestos que al ser disueltos en agua tienen la capacidad de aumentar la concentración de IONES HIDRONIO (H3O) + 1 .
BASES
Son sustancias se caracterizan por aumentar la concentración de IONES HIDROXILO (OH)+1 cuando están en solución con agua. Si en su fórmula contienen el anión (OH) - 1 se les conoce como HIDROXIDOS.
SALES
Son compuestos que se obtienen como producto de la NEUTRALIZACION de un ACIDO o de una BASE, ya sea por reacción entre ellos mismos o con algún METAL.
Estos compuestos se agrupan en familias en base a la FUNCION QUIMICA que cada uno de ellos ocupa al ponerse en contacto con otras sustancias.
Por ejemplo:
1.- Los OXIDOS, cuya función química es (O- 2), siendo compuestos BINARIOS se combinan con el agua para producir compuestos TERNARIOS.
a) Los OXIDOS METALICOS producen BASES de ahí el nombre alterno de OXIDOS BASICOS.
MgO + H2O ---> Mg(OH) 2
(Oxido de Magnesio ) (Hidróxido de Magnesio )
K2O + H2O à 2 KOH
Oxido de Potasio Hidróxido de Potasio
b) Los OXIDOS ACIDOS reciben este nombre por contener oxigeno en su molécula y porque al reaccionar con el agua producen sustancias con características ACIDAS, a las que se les llama OXIACIDOS..
SO3 + H2O --à H2SO4
Oxido de azufre VI ácido sulfúrico
Trióxido de azufre
(Anhídrido sulfúrico )
CO2 + H2O ---> H2CO3
Oxido de carbono IV ácido carbónico
Anhídrido carbónico
Bióxido de carbono
P2O5 + 3 H2O ---> 2H3PO4
Oxido de fósforo V ácido ortofosfórico o
Anhídrido fosfórico ácido fosfórico
Pentaóxido de difósforo
c) Un gran número de OXIDOS ACIDOS pueden también ser llamados ANHIDRIDOS dado que se obtienen mediante la deshidratación de algún OXIACIDO al ser sometido a calentamiento.
2 HNO3 ---> N2O5 + H2O
Acido Nítrico Anhídrido nítrico
H2SO3 ---> SO2 + H2O
Acido Sulfuroso Anhídrido sulfuroso
A las reacciones anteriores se les puede llamar DESHIDRATACION por la eliminación del Agua. Por eso el nombre de ANHIDRIDO que significa SIN AGUA.
2.- Los ACIDOS, cuya función química es (H3O)+1 pueden ser compuestos binarios o ternarios. Formados por la combinación del HIDROGENO con otro elemento o grupos de elementos de gran electronegatividad cuya principal característica es el aumento de IONES HIDRONIO (H3O) + 1 al ser disueltos en agua. Esto les confiere la propiedad de neutralizar los IONES HIDROXIDO (OH) - 1 liberados en las soluciones de las BASES formándose AGUA, además de una SAL producto de la combinación del ION negativo (ANION) y el positivo (CATION) liberados por el ACIDO y la BASE respectivamente.
H2SO4 + Mg(OH) 2 ---> MgSO4 + 2 H2O
Ácido Base Sal Agua
HCl + NaOH ---> NaCl + H2O
Ácido base sal agua
Otra característica de los ACIDOS es la liberación del HIDROGENO presente en ellos cuando reaccionan con algún METAL formándose también una SAL.
Zn + H2SO4 ---> ZnSO4 + H2
Metal ácido sal hidrógeno
Fe + HCl ---> FeCl2 + H2
Metal ácido sal hidrógeno
3.- Las BASES o HIDROXIDOS, cuya función química es (OH) - 1 al ser liberadoras del ANION HIDROXIDO (OH) - 1 serán capaces de neutralizar a los ACIDOS los cuales liberan el CATION de HIDROGENO (H) +1 formando AGUA, por lo que MUTUAMENTE SE NEUTRALIZAN originando sustancias de una relativa estabilidad.
2 Fe(OH) 3 + H2SO4 ---> Fe2(SO4) 3 + 6 H2O
base ácido sal agua
Al(OH) 3 + 3 HCl ---> AlCl3 + 3 H2O
Base ácido sal agua
Como se puede apreciar, las bases son compuestos TERNARIOS con la participación de un METAL el cual es realmente el que cede el electrón y que le confiere la carga negativa al ANION (OH) - 1, quedando él como un CATION. Esto origina que en interacciones entre compuestos que por su fórmula sean llamados hidróxidos, alguno de ellos tenga un comportamiento ACIDO, lo cual depende de la capacidad de ceder electrones de los metales. Aquel que tenga una mayor electronegatividad se comportara como NO METAL (Al) y el compuesto que lo posea se comportara como un ACIDO.
3 NaOH + Al(OH) 3 ---> Na3AlO3 + 3 H2O
base ácido sal agua
A los elementos que dependiendo de las condiciones pueden adquirir características de METAL o de NO METAL se le conoce como METALOIDE o ANFOTERO. Ejemplos: Zn, Mn, Al, Cr, W, As, Sb, etc.
4.- Las SALES son sustancias que se componen de un catión y un anión y son de una relativa estabilidad; su solubilidad y actividad química depende de los elementos que la integran. El CATION proviene de una BASE y el ANION su origen quizá sea un ACIDO, de los cuales se ha obtenido por NEUTRALIZACION de las características de ACIDO y BASE. Pueden ser compuestos BINARIOS, TERNARIOS o CUATERNARIOS.
K2SO4 (sal ternaria)
NaI (sal binaria)
KNaLiPO4 (Sal cuaternarios)
a) Las sales en solución pueden reaccionar entre sí para dar productos que a su vez son sales pero de mayor estabilidad:
AgNO3 + KCl ---> AgCl + KNO3
Sal sal sal sal
b) En compuestos con CATIONES o ANIONES multivalentes es posible que se den NEUTRALIZACIONES PARCIALES y por lo tanto las sales que así se originen podrán tener características ácidas o básicas.
NaOH + H2CO3 ---> NaHCO3 + H2O
sal ácida
Mg(OH) 2 + HCl ---> Mg(OH)Cl + H2O
sal básica
Este tipo de sales pueden ser neutralizadas con un ión diferente originando SALES MIXTAS.
NaHCO3 + KOH ---> KNaCO3 + H2O
sal ácida base sal mixta
Mg(OHCl + HBr ---> MgBrCl + H2O
sal básica ácido sal mixta
d) Sales HIDRATADAS.- En ocasiones las sales cristalizan absorbiendo moléculas de agua; a estas se les conoce como SALES HIDRATADAS, su fórmula se escribe anexándole el número de moléculas de agua a la cual se le conoce como AGUA DE CRISTALIZACION.
CaSO4 · 2 H2O (Sulfato de Calcio dihidratado)
CuSO4 · 5 H2O (Sulfato cúprico pentahidratado)
e) SALES DOBLES. Algunas sales se depositan formando cristales de dos tipos de sustancias; como ejemplo citaremos los compuestos llamados ALUMBRES cuya formación contiene SULFATOS DE CATIONES MONOVALENTES Y TRIVALENTES.
K2SO4 · Al2(SO4) 3 · 24 H2O (sulfato doble de aluminio y potasio hidratado).
5.- Compuestos de Coordinación.- También son conocidos como compuestos complejos; consisten regularmente en un elemento METALICO CENTRAL al cual se unen varios aniones y/o moléculas llamados LIGANDOS. Se dice que los ligandos están coordinados alrededor del METAL CENTRAL en la primera esfera de coordinación la cual se indica por paréntesis rectangulares y puede ser CATION o ANION.
K3[Fe(CN) 6] (Hexaciano ferrato III de potasio)
[Fe(CN) 6] - 3 (anión Hexaciano ferrato III)
[Cu(NH3) 4]Cl (cloruro de tetraamino cobre I)
[Cu(NH3) 4] + 1 (catión tetraamino cobre I)
Se puede apreciar que en la escritura de la fórmula de un complejo también se escribe primero el CATION seguido del ANION.
martes, 30 de marzo de 2010
CHICOS DE SEXTO Y SEPTIMO DE TRADICIONAL Y DE CICLOS.

ESTE ES EL TALLER QUE NECESITO ME REALICEN PARA VACACIONES TIENE QUE ENTREGARLO EN HOJAS TIPO EXAMEN A MANO Y EN LA CARPETA DE QUÍMICA. EL DÍA DE LA ENTREGA ES EL 6 DE ABRIL NO IMPORTA QUE QUE NO TENGAMOS CLASE ESE DÍA POR FAVOR SEAN PUNTALES YA QUE NO LO VOY A RECIBIR OTRO DÍA QUE NO SEA ESE.
1.escribe las principales propiedades periódicas
2.como se les llama a los elementos que se encuentran dentro de la tabla periódica, ubicados del grupo IIIB al VIIIB
3.es la unión física de dos o mas sustancias en cualquier proporción
4.como se le llama a la reacción en la que se desprende calor
5.elemento que pertenece a los metales de transición y que se obtiene de la naturaleza de manera sintética
6.a que se debe que se difunda el aroma de un perfume
7.que es el punto de ebullición
8.escribe la definición de los métodos de separación que conoces
9. clasifique cada una de las siguientes muestras en homogéneas y heterogéneas.
agua
sal de mesa.
arena.
sal y arena.
alcohol y agua.
alcohol y aceite.
agua, aceite y arena.
10. Escriba cinco ejemplos de sustancias puras, de soluciones y de mezclas heterogéneas.
11. ¿Qué criterio utilizó para clasificar una muestra liquida homogénea como sustancia pura o como solución?
12.que son las mezclas homogeneas y heterogeneas.
13. que son sustancias misibles.
14. que son sustancias inmisibles.
15. cuales son las caracteristicas de los cambios de estado.
TALLERES DE QUIMICA BASICA PARA LOS ALUMNOS DE OCATVO Y NOVENO CICLOS Y TRADICIONAL

JÓVENES ESTE TALLER ES ANEXO A LA NOTA DE SU EXAMEN ACUMULATIVO, SON TEMAS QUE YA HEMOS VISTO EN LOS HEMOS VISTO EN CURSOS ANTERIORES NO ES NADA NUEVO ES MERA TEORÍA ASÍ QUE ESTUDIEN , ADEMAS ESTUDIEN LOS APUNTES DE CLASE Y LOS TALLERES SOBRETODO LOS ALUMNOS DE NOVENO QUE LLEVAN MEJOR LOS CUADERNOS Y CREO QUE SON MAS APLICADOS...YO SE QUE USTEDES PUEDEN CON ESTO....
1.escribe las principales propiedades periódicas
2.como se les llama a los elementos que se encuentran dentro de la tabla periódica, ubicados del grupo IIIB al VIIIB
3.es la unión física de dos o mas sustancias en cualquier proporción
4.como se le llama a la reacción en la que se desprende calor
5.elemento que pertenece a los metales de transición y que se obtiene de la naturaleza de manera sintética
6.a que se debe que se difunda el aroma de un perfume
7.que es el punto de ebullición.
8. es el material sólido no cristalino formado por la fusión a altas temperaturas de la arena con carbonato de sodio
9.como se le llama al proceso en el cual las moléculas pasan directamente de la fase de vapor a la fase sólida
10.define a los tipos de energía
11.explica el efecto fotoelectrico
12.menciona que partícula es la que determina las propiedades tanto físicas como químicas de los elementos.
CALCULAR:
1) Calcular la densidad en g/cm3 de:
a) granito, si una pieza rectangular de 0,05 m x 0,1 m x 23 cm, tiene una masa de 3,22 kg.
b) leche, si 2 litros tienen una masa de 2,06 kg.
c) cemento, si una pieza rectangular de 2 cm x 2 cm x 9 cm, tiene una masa de 108 g.
d) nafta, si 9 litros tienen una masa de 6.120 g.
e) Marfil, si una pieza rectangular de 23 cm x 15 cm x 15,5 cm, tienen una masa de 10,22 kg.
2) Calcular la masa de:
a) 6,96 cm3 de cromato de amónio y magnesio si la densidad es de 1,84 g/cm3.
b) 86 cm3 de fosfato de bismuto si la densidad es de 6,32 g/cm3.
c) 253 mm3 de oro si la densidad es de 19,3 g/cm3.
d) 1 m3 de nitrógeno si la densidad es de 1,25 g/l.
e) 3,02 cm3 de bismuto si la densidad es de 9,8 g/cm3.
f) 610 cm3 de perclorato de bario si la densidad es de 2,74 g/cm3.
g) 3,28 cm3 de antimonio si la densidad es de 6,7 g/cm3.
3) Calcular el volumen de:
a) 3,37 g de cloruro de calcio si la densidad es de 2,15 g/cm3.
b) 40,5 g de silicato de cromo si la densidad es de 5,5 g/cm3.
c) 2,13 kg de estaño si la densidad es de 7,28 g/cm3.
d) 12,5 g de hierro si la densidad es de 7,87 g/cm3.
e) 706 g de sulfato de cerio si la densidad es de 3,17 g/cm3.
f) 32,9 g de magnesio si la densidad es de 1,74 g/cm3.
lunes, 29 de marzo de 2010
CHICOS DE DÉCIMO TRADICIONAL Y CICLOS ESTE ES EL TALLERCITO.....

MUCHACHOS ESTE ES EL TALLER QUE QUEDO PROPUESTO PARA LA MATERIA DE QUÍMICA PARA LOS DOS DECIMOS LO ÚNICO QUE VARIA ES QUE LOS MUCHACHOS DE TRADICIONAL DE VAN A DESARROLLAR SOLO HASTA LOS EJERCICIOS QUE SE VIERON EN CLASE ES DECIR: TEORÍA ATÓMICA, PESOS MOLECULARES, CONFIGURACIÓN ELECTRÓNICA, MOL, MOLÉCULA, NUMERO DE AVOGADRO Y UBICACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓDICA....LOS DEMÁS TEMAS SON DE LOS MUCHACHOS DE CICLOS...LA FORMA DE PRESENTACIÓN YA SABEN QUE ES A MANO EN HOJAS TIPO EXAMEN Y DENTRO DE LA CARPETA Y QUE EL MARTES 6 DE ABRIL LO TRABAJAMOS TODO EL TALLER RESOLVEMOS DUDAS Y ME LLEVO LO TALLERES PARA CALIFICARLOS CON TODA LA CARPETA ADEMAS RECOJO EL DÍA 6 DE ABRIL COMO QUEDO ESTIPULADO EN LA CLASE. NO SALGAN CON EXCUSAS POR FAVOR... TODAS LAS RESPUESTAS DEBEN SER DEBIDAMENTE ARGUMENTADAS, ES DECIR ME DEBEN DECIR PORQUE ESTAN DANDO USTEDES ESA RESPUESTA, SI NO LO HACEN DE ESA MANERA LA RESPUESTA
Cuestionario estructura materia y modelos atómicos
1) Explique la teoría atómica planteada por:
a) Leucipo
b) Demócrito
2) ¿Cuál fue el antecedente a partir del cual Dalton postulo el modelo
Atómico?
3) De los antecedentes Dalton, indique dos conclusiones de los que ellos se
Pueden deducir.
4) De los postulados propuestos por Dalton, explique hoy día ¿Cuáles son
Ciertos y cuales son erróneos? Fundamente su respuesta.
5) Señale los postulados de la teoría atómica de Dalton.
6) Explique cual es el principio de la bomba atómica
7) ¿Qué importancia y aprehensiones tuvo la expresión para
Einstein?
8) ¿En que consiste y como funciona un reactor nuclear?
9) ¿Cuál es la idea principal del modelo atómico de Thomsom?
10) ¿Qué son los rayos catódicos?
11) En qué consistió el experimento utilizado en un tubo de clases
12)¿Cuál fue el objetivo de usar un campo eléctrico en un tubo de
Descarga?
13) ¿Qué avances significo el modelo planteado por Thomsom, frente al de
Dalton?
14) ¿De qué manera se puede electrificar una determinada materia?
15) Explique en qué artefacto tecnológico actual se usan los rayos catódicos
y cómo funcionan?
Ejercicios de estructura atómica y de configuración electrónica
1. El primer modelo atómico fue planteado por:
A. Demócrito
B. Thompson.
C. Dalton
D. Lavoisier.
2. La materia está formada por partículas diminutas e indivisibles llamadas “átomos” este postulado pertenece a:
A. Dalton.
B. Rutherford.
C. Thomson.
D. Demócrito y Leucipo.
3. La masa del átomo se concentra en:
A. Periferia.
B. Protones.
C. Neutrones.
D. Núcleo.
4. Para un elemento los valores Z y A son respectivamente 92 y 238 por tanto, el número de neutrones es:
A. 92.
B. 146.
C. 330.
D. 258.
5. La clasificación actual del los elementos químicos se debe a:
A. Newlands.
B. Meyer y Mendeleiev.
C. Faraday y Newlands.
D. Dobereiner.
6. Un átomo cuya configuración electrónica es 1s2 2s2 2p6 3s2 3p6 4s2tiene
A. El subnivel 2s incompleto.
B. Incompleto el tercer nivel energético principal.
C. Incompleto el subnivel 3s.
D. incompleto el primer nivel energético.
7. Un isótopo del hidrógeno está formado por un protón, dos neutrones y un electrón. El número de masa atómica de este isótopo es:
A. 1
B.2.
C. 3
D. 4.
8. En el tercer nivel energético principal, el subnivel de máxima energía es:
A: s.
B: P.
C: D.
D: F
9. La capacidad de combinación de un átomo se denomina:
A. Afinidad electrónica.
B. oxidación.
C. Reducción.
D. valencia.
10.El isótopo de un elemento tiene :
A. Número diferente de electrones.
B. Número diferente de protones.
C. Número atómico diferente.
D. Número de masa diferente
11. El número total de electrones no apareados en un átomo de nitrógeno en estado normal es:
A. 5.
B. 3.
C. 2
D. 4
12. La configuración electrónica correspondiente al elemento Arsénico (As) con número atómico 33 es :
A. 1s2 2s2 2p6 3s2 4s2 3p6 4p6 5s2 3d5
B. 1s2 2s2 2p6 2d10 3s2 3p6 4s2 4p3
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
d. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
13. El número atómico del Fósforo es 15, esto significa:
A. El Fósforo tiene 15 neutrones.
b. El Fósforo tiene 15 electrones.
c. El Fósforo tiene 15 partículas en su núcleo.
d. El Fósforo tiene 8 protones y 7 electrones.
14. El núcleo de un átomo, con Z= 8 y masa atómica 16, contiene:
a. 16 neutrones.
b. 8 protones y 8 electrones.
c. 8 protones y 8 neutrones
d. 16 protones.
15. El tritio es un isótopo del hidrógeno, que consta de:
a. Un protón, un electrón y un neutrón.
b. Dos protones, un neutrón y un electrón.
c. Un protón, un neutrón y dos electrones.
d. Un protón, dos neutrones y un electrón.
16. La configuración electrónica correspondiente al elemento Rubidio (Rb) con número atómico 37 es:
a. 1s2 2s2 2p6 3s2 4s2 3p6 4p6 5s2 3d5
b. 1s2 2s2 2p6 2d10 3s2 3p6 4s2 4p3
c. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
d. 1s2 2s2 2p6 3s2 3p6 4s2 3d7 4p6
17. Según la configuración electrónica anterior, la ubicación en la tabla periódica de elemento Rubidio es:
a. Período 4, grupo VI A
b. Período 4, grupo III A
c. Período 5, grupo IA.
d. Período 3, grupo IV A
18. Si un elemento A tiene Z= 4 y otro elemento B tiene Z= 9, ambos elementos se encuentran en el mismo período, se puede afirmar que:
a. A y B están en el tercer período.
b. A y B pertenecen al grupo III A.
c. A es más electronegativo que B.
d. A es menos electronegativo que B
19. El elemento con configuración electrónica:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p65s2 4d5 está ubicado en el:
a. Período 5, grupo II A.
b. Período 4, grupo V B.
c. Período 5, grupo VII B.
d. Período 5, grupo II B.
20. En la tabla periódica los elementos más electronegativos se encuentran
a. Arriba a la derecha.
b. Arriba a la izquierda.
c. Abajo a la derecha.
d. Abajo a la izquierda.
21. Si tenemos la distribución electrónica de un elemento no podemos predecir:
a. Número de protones en el núcleo.
b. el peso atómico.
c. Periodo al que pertenece.
d. Grupo al que pertenece
22. Un átomo contiene 4 protones, 4 electrones y 5 neutrones. La masa atómica para el átomo es:
a. 5.
B. 6.
c. 7.
d. 9.
23. Del Ca con Z=20 y del Se con Z=34 se puede afirmar:
a. Los dos tienen 5 niveles de energía.
b. el Ca es mas pequeño que el Se.
c. El Se es más electronegativo que el Ca.
d. El Ca necesita mas energía de ionización que el Se.
24. Si el S pertenece al grupo VI A y su período es el tercero, se puede afirmar que:
a. Tiene 3 electrones de valencia.
b. Su ultimo nivel de energía es el 6.
c. Tiene 6 electrones en el nivel 3.
d. Su configuración electrónica final es 3s2 2d4
Contesta las preguntas 25 y 26 teniendo en cuenta los siguientes átomos neutros, teniendo en cuenta que P es del grupo VIIIA (Gas noble); 7J 12Z 10P 9Y 5K
25. El elemento con mayor radio atómico es:
A. J.
B. Z.
C. P.
D. K
26. El elemento más electronegativo es:
a. Z
B. Y.
C. K.
D. J.
27. Indica el orden correcto, de menor a mayor, de la masa del protón, neutrón y electrón:
a. protón < electrón < neutrón.
b. electrón < neutrón < protón.
c. neutrón < protón < electrón.
d. electrón < protón ≤ neutrón.
PROBLEMA 1:
En 68,0 g de X2O7 hay 1,505.1023 moléculas de dicho compuesto. Calcular:
a) El número de moles de X2O7 presentes en la muestra
b) La masa atómica relativa del elemento X
c) La masa, en gramos, de una molécula de X2O7
PROBLEMA 2:
Un compuesto orgánico líquido cuya fórmula molecular es CxH6O, a 25°C y 1 atm, tiene una densidad de 0,791 g.cm-3 y un volumen molar de 73,32 cm3.mol-1. Calcular:
a) La masa, en gramos, de un mol de CxH6O
b) El número de moléculas presentes en 1 cm3 del compuesto
c) El número de moles de átomos de C presentes en 1 cm3 de líquido
PROBLEMA 3:
En 290 g de CxH16O hay 2,408.1025 átomos de hidrógeno. Calcular:
a) El número de moles de moléculas de CxH16O presentes en la muestra
b) La atomicidad del carbono en el compuesto CxH16O
c) La masa, en gramos, de una molécula de CxH16O
PROBLEMA 4:
485 cm3 de una muestra del compuesto líquido CxH12 a 25°C y presión normal contienen 54 mol de átomos de hidrógeno. La densidad del compuesto en dichas condiciones es 0,7794 g.cm-3. Calcular:
a) El número de moles de moléculas de CxH12 presentes en la muestra
b) La atomicidad del carbono en el compuesto CxH12
c) La masa, en umas, de una molécula de CxH12
PROBLEMA 5:
Un recipiente contiene una cierta cantidad de CS2 (líquido) a 22°C y 1 atm, en la que hay presentes 3,61.1024 átomos de S. Su densidad en esas condiciones es 1,26 g.cm-3. Calcular:
a) El volumen de líquido contenido en el recipiente
b) El número de moles de moléculas presentes
c) La masa, en gramos, de un mol de moléculas de CS2
PROBLEMA 6:
En 292 cm3 de C2H6O líquido a 25°C y presión normal hay 3,01.1024 moléculas. Calcular:
a) El número de moles de átomos de hidrógeno presentes en la muestra
b) La densidad del compuesto en dichas condiciones
c) La masa, en gramos, de una molécula de C2H6O
PROBLEMA 7:
Se tienen 63,6 cm3 de un compuesto orgánico CxH8 (líquido) a 20°C y 1 atm, cuya densidad es 0,868 g.cm-3 y su volumen molar es 106 cm3.mol-1. Calcular:
a) El número de moléculas presentes en la muestra
b) El número de moles de átomos de C presentes
c) La masa, en gramos, de una molécula del compuesto
PROBLEMA 8:
El elemento X forma con el carbono un compuesto líquido a 25°C y 1 atm, cuya fórmula molecular es CX2. En esas condiciones, su densidad es 1,26 g.cm-3 y su volumen molar es 60,32 cm3.mol-1. Calcular:
a) La masa atómica relativa del elemento X
b) El número de átomos de X presentes en 30,4 g del compuesto
c) La masa, en gramos, de una molécula de CX2
ALUMNOS DE CICLOS EN ESTA DIRECCIÓN VAN A ENCONTRAR LOS EJERCICIOS DE ENLACE QUE QUIERO QUE DESARROLLEN
http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/prof/bloque_iv/ejercicios_bl_4_ap_1.pdf">
Suscribirse a:
Comentarios (Atom)


